Cos’è la farmacovigilanza?
La farmacovigilanza è l’insieme delle attività finalizzate all'identificazione, valutazione, comprensione e prevenzione degli effetti avversi o di qualsiasi altro problema correlato all'uso dei medicinali, per assicurare un rapporto beneficio/rischio favorevole per la popolazione.
La farmacovigilanza contribuisce alla tutela della salute pubblica.
I dati sulla sicurezza dei farmaci possono essere ricavati da differenti fonti: segnalazioni di sospette reazioni avverse (spontanee e non), studi clinici, letteratura scientifica, rapporti inviati dalle industrie farmaceutiche, ecc. (Fonte: Aifa).
Come segnalare una sospetta reazione avversa
Le segnalazioni di sospette reazioni avverse (ADR, Adverse Drug Reaction in inglese) da farmaci e da vaccini consentono di rilevare potenziali segnali di allarme relativi all’uso dei medicinali così da renderli più sicuri, a beneficio di tutti i pazienti.
La normativa europea sulla farmacovigilanza richiede a tutti gli operatori sanitari e ai cittadini di segnalare qualsiasi sospetta reazione avversa (grave e non grave, nota e non nota).
Una sospetta reazione avversa può essere segnalata secondo una delle seguenti modalità:
- Compilando la scheda di segnalazione di sospetta reazione avversa e inviandola:
- al Responsabile Locale di farmacovigilanza della propria struttura di appartenenza via e-mail (vedi contatto nella sezione sottostante) oppure
- al Titolare dell’Autorizzazione all’Immissione in Commercio (AIC) del medicinale che si sospetta abbia causato la reazione avversa
- Compilando la scheda di segnalazione direttamente online sul sito di Aifa.
La Rete Nazionale di Farmacovigilanza (RNF)
La Rete Nazionale di Farmacovigilanza garantisce:
- la raccolta
- la gestione
- l'analisi
delle segnalazioni di sospette reazioni avverse a farmaci (ADR).
La rete è raggiungibile dal sito web dell'Aifa tramite la sezione "Farmacovigilanza" o collegandosi direttamente al seguente link: https://www.aifa.gov.it/farmacovigilanza1.
Gli attori: profili utente
Alla RNF possono accedere solo gli utenti registrati al Portale dei Servizi di Aifa.
Utenti che devono registrarsi ai sistemi informativi Aifa:
- Aifa (Area Vigilanza Post Marketing)
- Consultazione (Aifa, ISS)
- Ministero Salute (Dipartimento Prevenzione)
- Regioni
- Centri regionali di FV
- Dipartimenti di Prevenzione regionali (Consultazione vaccini)
- Azienda ospedaliera - Asl - IRCCS
- Polizia/Forze armate
- Azienda farmaceutica
Gli utenti coinvolti, dovendo svolgere funzioni diverse in relazione al proprio ruolo, hanno profili di accesso, gestione e visibilità differenti.
Utenti che non devono registrarsi:
- Cittadino
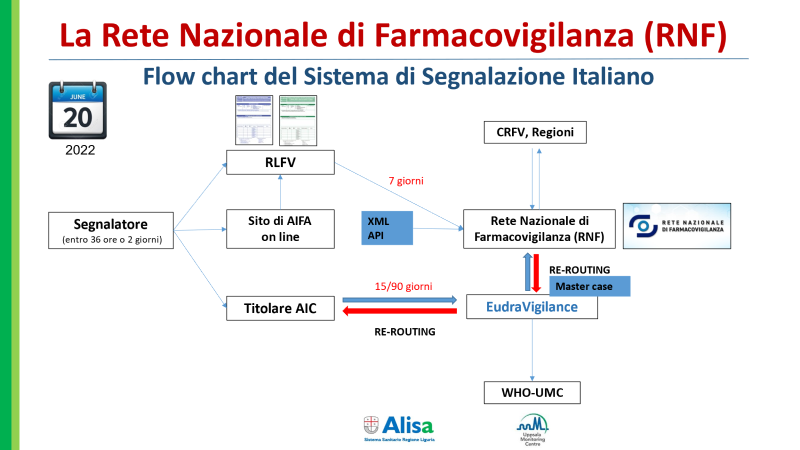
Grazie alla nuova normativa, come descritto nell’immagine sottoriportata, le segnalazioni di Farmacovigilanza convergono in Data Base internazionali (Eudravigilance e WHO- UMC). Questa modalità di monitoraggio permettere di attivare efficaci sinergie per la promozione della sicurezza.
La farmacovigilanza in Regione Liguria
In Regione Liguria, Alisa ha il compito della gestione e del coordinamento delle attività di Farmacovigilanza che si realizzano con il contributo della rete regionale e del CRIFF. In particolare, il Direttore della. S.C. Politiche del Farmaco, Dispositivi Medici, Protesica ed Integrativa è responsabile regionale di Farmacovigilanza e referente scientifico di farmacovigilanza per il coordinamento delle attività del CRFV e di tutti i progetti regionali, multiregionali e nazionali nonché della verifica dello stato di avanzamento degli stessi, nel rispetto degli indirizzi e delle indicazioni forniti da Aifa.
La Rete Regionale di Farmacovigilanza
Responsabile regionale FV
Gestione e coordinamento delle attività di Farmacovigilanza nonché funzione di “Approvatore regionale utenze” (AUA) con il compito di abilitare o disabilitare all’uso della RNF gli utenti afferenti alle strutture sanitarie di propria competenza territoriale.
Responsabili locali FV
Si occupano della gestione delle segnalazioni di sospetta reazione avversa a medicinali di propria competenza e relativo inserimento in RNF entro la tempistica prevista; dei feedback ai segnalatori; della diffusione delle informazioni e formazione sulla Farmacovigilanza agli operatori sanitari.
Responsabili di Farmacovigilanza in Regione Liguria
Responsabile regionale di FV
Alisa
Barbara Rebesco
010 548 8158
Responsabili locali di FV
Asl1
Valeria Cacciato
0184 536 504
Asl2
Marco Bessero
019 84 05755
Asl3
Francesca Giannoni
010 849 7151
Asl4
Alessandro Brega
0185 329 471
Asl5
Alessandro Sarteschi
0187 604 736
IRCCS Policlinico San Martino
Sabrina Beltramini
010 555 2254 / 2040
IRCCS G. Gaslini
Paola Barabino
010 5636 3402
Ospedale Evangelico Internazionale
Federica Morotti
010 5522 9981
Ospedale Galliera
Carla Fraguglia
010 563 4311
Centro Regionale Farmacovigilanza e Informazione indipendente Farmaco
Responsabile del centro regionale di FV (CRIFF)
Maria Caterina Merlano
010 548 8539
Il Centro Regionale per la Farmacovigilanza e l’Informazione indipendente sul Farmaco nasce nel 2009 con l’intento di porre la Regione al centro degli interventi per migliorare la sicurezza nell’uso dei farmaci, per valutare i rischi ed i benefici derivanti dal loro utilizzo, nonché per approfondire le conoscenze in materia di rischio terapeutico.
I compiti del CRIFF sono quelli di stimolare la cultura e la segnalazione delle reazioni avverse da farmaci, sviluppando una fattiva collaborazione tra Alisa/Regione, Enti del Sistema sanitario regionale (Asl, AO, IRCCS) Aifa e cittadini.
Al fine di produrre quel cambiamento culturale auspicato, il CRIFF adotta inoltre iniziative di formazione e informazione a favore del personale sanitario e dei cittadini, permettendo l’accesso alle banche dati riguardanti l’informazione farmaceutica e ai documenti scientifici correlati.
Per maggiori informazioni
Centro Regionale per la Farmacovigilanza e l’Informazione indipendente sul Farmaco (CRIFF)
Via G. D'annunzio, 64
16121 Genova
010 548 8539 - 8564
Progetti di farmacovigilanza attiva
L’Aifa promuove programmi e studi di farmacovigilanza attiva con l’obiettivo di aumentare le conoscenze sui medicinali e definire meglio la loro sicurezza d’uso, migliorare le modalità con cui vengono utilizzati, stabilire un profilo di sicurezza che meglio corrisponda alla reale pratica medica e descrivere in maniera più realistica le caratteristiche dei pazienti in trattamento.
Si fornisce l’elenco dei progetti regionali condotti da Alisa e dagli Enti del SSR:
- Reazioni da ipersensibilità a farmaci chemioterapici e biologici: individuazione e gestione dei pazienti in regione Liguria;
- Monitoraggio dell'intolleranza alle statine in pazienti a rischio cardiovascolare molto elevato o affetti da ipercolesterolemia familiare eterozigote per la gestione appropriata dei farmaci ipolipemizzanti innovativi (anticorpi monoclonali ANTI‐PCSK9);
- Valutazione delle interazioni Farmacologiche e reazioni avverse in pazienti anziani in politerapia presso le Residenze Sanitarie Protette.
Si fornisce l’elenco dei progetti multiregionali condotti da Alisa e dagli Enti del SSR:
- Implementazione di un modello di gestione integrata delle terapie oncologiche per assicurare la qualità delle cure: progetto multiregionale di sicurezza ed efficacia su farmaci oncologici innovativi;
- Programma di Oncovigilanza per la sicurezza dei pazienti in trattamento chemioterapico;
- VigiFarmacoVax: Sorveglianza sulle reazioni avverse da vaccino.
Per il dettaglio delle attività, si rimanda alla tabella sinottica disponibile nel documento Progetti di Farmacovigilanza Attiva - aggiornamento del 15.01.2023
Riferimenti normativi e documenti utili
Riferimenti normativi
- Direttiva 2010/84/UE
- Regolamento UE 1235/2010
- Regolamento UE 520/2012
- Decreto Ministero della Salute 30 aprile 2015
- Legge Regionale n. 17 del 29/07/2016
- G.R. n. 228 del 24.03.2017
Documenti utili
- Deliberazione del Direttore Generale n. 306 del 11.12.2024
- Deliberazione del Direttore Generale n. 10 del 15.01.2024 e allegato
- Deliberazione del Direttore Generale n. 285 del 20.11.2023
- Deliberazione del Direttore Generale n. 314 del 20.10.2022
- Deliberazione del Commissario Straordinario n. 21 del 01.02.2021
- Deliberazione del Commissario Straordinario n. 16 del 22.01.2020
- Deliberazione del Commissario Straordinario n. 23 del 29.01.2020
- Deliberazione del Commissario Straordinario n. 315 del 12.12.2018
In evidenza
-
05 Luglio 2012
Raccomandazioni del Working Group Pediatrico dell'AIFA su Paroxetina ed Olanzapina
-
05 Luglio 2012
Raccomandazioni del Working Group Pediatrico dell'AIFA sull'uso dei Fans
-
05 Luglio 2012
10 suggerimenti per l'uso sicuro dei farmaci
-
05 Luglio 2012
Promozione dell'uso prudente degli antibiotici negli ospedali
